الاتجاهات الدورية 3
اختر الإجابة الصحيحة.
ما الاتجاه الدورِيُّ في الدورة 3 يُوضَحُ هذا الجدول خصائص بَعضٍ عَناصر الجدول الدوري.
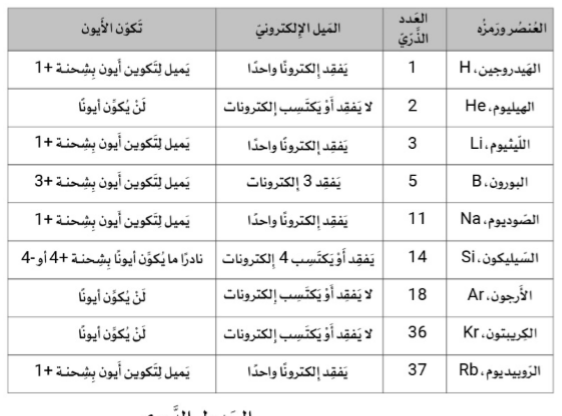

تميلُ العناصر الموجودة على اليَسار إلى عدم تكوين أيوناتٍ، بَينَما تَمِيلُ العَناصِرُ الموجودة في أقصى اليمين إلى تكوين أَيوناتٍ مُوجَبَةٍ .
تميلُ العَناصِرُ المَوجودةُ على اليَسار إلى تكوين أَيوناتٍ مُوجَبَةٍ ، بَيْنَمَا لا تَمِيلُ العَناصِرُ الموجودة في أقصى اليمين إلى تكوين أَيونات. ✔️
جميع العناصر في الدورةِ نَفسِها تُكوّنُ أَيوناتٍ مِنْ نَفْسِ الشَّحْنَةِ.
اختر الإجابة الصَّحيحَةَ مِنَ القائِمَةِ المُنسدلة.
العدد الذري للنيتروجين هو .7 . الترتيب الإلكتروني لأيون النيتروجين هو .1s2 2s2 2p3
شِحنَةُ أَيون النيتروجين 3 ✔️
اختر الإجابة الصحيحة.
العددُ الذَّرُيُّ للأَرجونِ (Ar) هو 18. التَّرتيب الإلكتروني له هو .1s2 2s2 2p6 3s2 3p6
كَيفَ يُمكن استخدامُ التَّرتيب الإلكتروني للغاز النَّبيل الأرجونِ (Ar) لمعرِفَةِ أَنَّهُ عُنصُرُ مُستقر ؟
تمتلئ الأفلاك 3S و 3p الخارجيَّةُ كُليًّا. ✔️
هُناكَ ثَلاثُ مجموعاتٍ مِنَ الأفلاكِ .S.
هناك مجموعتانِ مِنَ الأفلاكِ
تمتلئ مستويات الطاقةِ الرئيسة الأولى والثانية كليًا؛ لذلك لن تتفاعل الذرّة.
تُوجد 8 إلكتروناتِ تكافؤ فِي أَعلى مستوى طاقَةٍ رَئيس . ✔️
تُوجد 6 إلكتروناتِ تكافؤ فِي أَعلى مستوى طاقَةٍ رَئيس .
اختر الإجابَةَ الصَّحيحَة مِنَ القائِمَةِ المُنسدلة لتكمل الجملة.
تميل الأفلاكُ S و p المملوءةُ كُلَّيًّا إلى تكوين ترتيب إلكتروني مستقر ✔️
اختر الإجابةَ الصَّحيحَةَ مِنَ القائِمَةِ المُنسدلة لتكمل الجملة.
تُعَدُّ العَناصِرُ في الدَّورة 1 ✔️ استثناءً لقاعدةِ الثَّمانيةِ . تَصلُ هَذهِ العَناصر إلى ترتيب إلكتروني مستقر عِند وجود إلكتروني تكافؤ فَقَط في مُستويات الطاقةِ الرئيسة الخارجيَّةِ.
اختر الإجاباتِ الصّحيحة.
يُستخدم الكلور والبرومُ واليودُ في عَمليَّاتِ التَّطهير والتَّنظيف ؛ لأَنَّ هَذهِ العَناصِرَ تَتَفاعَلُ بِسُرعةٍ ، كَما أَنَّ هَذهِ جميع العَناصِرِ مَوجودةُ في المَجموعَةِ .17. أَيُّ مِنَ الاتجاهاتِ التَّاليةِ يَنطِقُ عَلَى هَذهِ العَناصِرِ؟
تَفقَدُ هَذِهِ العَناصِرُ سَبْعَةَ إِلكتروناتِ تكافؤ.
تَمْلكُ هَذِهِ العناصر سَبْعَةَ إِلكتروناتِ تكافؤ. ✔️
تفقدُ هَذهِ العناصر إلكترونا واحدًا.
تَكونُ هَذهِ العَناصِرُ أَيونات مشحونَةً بِشحنَةِ -1. ✔️
تَكْتَسِبُ هَذهِ العَناصِرُ سَبْعَةَ إِلكتروناتِ تكافؤ.
تَكونُ هَذهِ العَناصِرُ أَيونات مشحونَةً بِشِحْنَةِ +1 .
اختر الإجابة الصّحيحَةَ مِنَ القائِمَةِ المُنسدلة لتكمل الجملة.
تَنصُّ قاعدةُ الثَّمَانِيَةُ على أَنَّ الذَّرَّاتِ تَميل إلى اكتساب الإلكتروناتِ أَوْ فَقدِهَا أَوْ مُشارَكَتِهَا مِنْ أَجلِ
الحصول على 8 ✔️ إلكتروناتِ تكافؤ فِي مُستوياتِ طاقتِها الرئيسة الخارجيَّةِ.
اختر الإجاباتِ الصَّحيحة.
تَمَعَنُ بالتَّرتيب الإلكتروني أدناه لِذرة وأيون السيزيوم :
ذرة السيزيوم : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s1
أيون السيزيوم : 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6
أَيُّ مِنَ العباراتِ التَّاليةِ صَحِيحٌ حَولَ مُستوياتِ الطَّاقَةِ الرَّئيسة الخارجيَّةِ ؟
عِندَ تَكونِ الأَيونِ، يَتغيَّرُ مُستوى الطاقةِ الرَّئيسُ الَّذي يَحتوي على إلكتروناتِ التكافؤ. ✔️
يُوجد 54 مستوى طاقة في أيون السيزيوم.
هُناكَ خَمْسَةُ إِلكترونات في أعلى مستوى طاقَةِ رَئيس.
للأيون شحنة - 1 ؛ بسبب فقد إلكترون واحد.
فَقَدَ الفَلكُ الخارجي 6S إلكتروناً واحدا. ✔️
التَّرتيب الإلكتروني للسيزيوم هو نَفْسُهُ للزينون.
